ARX788 I期临床结果在《Clinical Cancer Research》正式发表
2022年5月31日,浙江新码生物医药有限公司临床阶段产品ARX788的HER2阳性晚期乳腺癌I期临床试验结果在国际知名医学期刊《Clinical Cancer Research》在线发表。
ARX788是一种靶向HER2受体的具有良好均一性和稳定性的抗体偶联药物(ADC),其由2个细胞毒素分子(微管蛋白抑制剂)与曲妥珠单抗定点偶联而成。在分子设计阶段,已通过优化细胞毒素分子与曲妥珠单抗偶联的数量、位置和化学键使ARX788得以发挥最佳的性能。
该项研究由复旦大学附属肿瘤医院胡夕春教授及其团队主持,是一项单中心、开放、剂量递增的I期临床研究,皆在评价ARX788单药治疗HER2阳性晚期乳腺癌的安全性、耐受性和药代动力学特征。研究设置了0.33 ~1.5mg/kg共9个剂量组。
总共有69名受试者参与了该项研究,没有发生DLT或与药物相关的死亡。大多数患者(67/69;97.1%)经历了至少一种与治疗相关的不良事件(TRAE),常见(≥30%)TRAE包括天冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高、角膜上皮病变、脱发、低钾血症、间质性肺病ILD/肺炎和醛固酮升高。虽有34.8%的受试者发生间质性肺炎,但仅两位的严重程度为3级。在1.5 mg/kg Q3W(II期推荐剂量)下,客观缓解率ORR为65.5%(19/29,95% CI,45.7~82.1),疾病控制率DCR为100%(95% CI,81.2~100),中位无进展生存期PFS为17.02个月(95% CI,10.09至未达到)。
研究显示,ARX788安全性可控,并在HER2阳性晚期乳腺癌患者中表现出优秀的抗肿瘤活性。
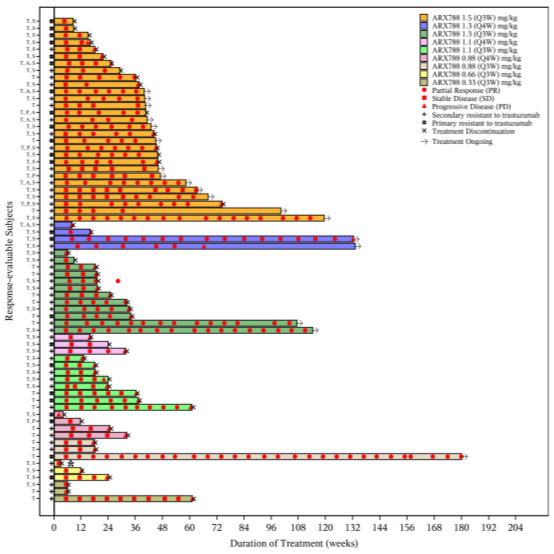
按剂量水平划分的生存泳道图(n=69)。
生存泳道图显示受试者的疗效和疗效持续时间。*不可评估(NE)。T:曲妥珠单抗;P:帕妥珠单抗;A:抗HER2 ADC;S:小分子抗HER2 TKI
ARX788相关信息
2021年1月获得FDA授予快速通道资格,用于治疗已接受过一种或多种抗HER2治疗的晚期或转移性HER2阳性乳腺癌;
2021年3月获得FDA授予孤儿药资格,用于治疗HER2阳性胃癌和胃食道结合部癌;
2021年5月纳入中国国家药监局药品审评中心(CDE)突破性治疗品种,适应症为:HER2阳性晚期乳腺癌二线治疗。
论文链接:
https://aacrjournals.org/clincancerres/article-abstract/doi/10.1158/1078-0432.CCR-22-0456/699249/Phase-I-Trial-of-a-Novel-Anti-HER2-Antibody-drug?redirectedFrom=fulltext



