新码生物在2020 CSCO年会上公布ARX788重要临床数据公布
2020年9月26日,研究者复旦大学肿瘤医院胡夕春教授代表浙江新码生物医药有限公司(以下简称“新码生物”)在2020年中国临床肿瘤协会(CSCO)学术年会上公布了重组人源化抗HER2单抗-AS269偶联药物(ARX788)的I期重要临床数据。

胡夕春教授是复旦大学附属肿瘤医院肿瘤内科主任医师、教授、博士生导师,致力于肿瘤化疗,尤其是乳腺癌内科治疗的研究。担任International Journal of Biological Markers、Journal of Bone Oncology、中华乳腺病杂志、中国癌症杂志、临床肿瘤学杂志和中德临床肿瘤学杂志编委,曾获中国抗癌协会科技奖一等奖、上海市医学科技进步奖一等奖、全国妇幼健康科学技术奖一等奖等多项奖项。
ARX788为新一代单抗偶联药物,采用美国Ambrx公司定点偶联工艺专有技术,首创利用非天然氨基酸插入蛋白质,实现毒素在单抗分子上的精确偶联。目前用于治疗HER2阳性晚期乳腺癌和胃癌等。ARX788已在澳大利亚、新西兰、美国、开展I期临床研究,启动了针对HER2阳性晚期乳腺癌的II/III期临床研究,并即将启动针对HER2阳性晚期胃癌的II/III期临床研究。
浙江新码生物医药有限公司为浙江医药股份有限公司(股票代码:600216 SH)子公司,于2017年1月18日成立,位于浙江绍兴滨海新城科创园。公司以“创新科技满足临床需求”为宗旨,主要致力于生物制品的研发生产。公司现已建成生物制药实验室,具备从基因工程构建、细胞培养、毒素合成、ADC偶联、制剂灌装、临床前研究和临床研究方面的经验和能力。
关于研究/About Reseach
01研究方法
这是一项单中心、开放、剂量递增的I期临床研究,皆在评价ARX788单药治疗HER2阳性晚期乳腺癌的安全性、耐受性和药代动力学特征。研究设置了0.33 ~1.5mg/kg共9个剂量组,同时对于肺部毒性特别设置了84天的剂量限制性毒性(DLT)观察期。
02研究结果
截止2020年08月11日,共入组59例HER2阳性晚期乳腺癌患者。其中100%的患者既往接受过曲妥珠单抗,34.2%的患者既往接受过拉帕替尼,22%的患者既往接收过吡咯替尼的治疗,中位治疗线数为5线。
所有剂量水平均未观察到剂量限制性毒性,且未达到较大耐受剂量。绝大数的不良事件为1-2级,仅7例(7/59,11.9%)患者发生与研究药物相关的3级及以上不良事件,1例(1/59,1.7%)患者发生了与研究药物相关的严重不良事件。几乎没有观察到ADC药物常见的3级及以上的血液毒性(例如血小板减少、白细胞减少等),常见的值得关注的不良事件为AST、ALT升高(均为2级及以下)、肺间质病变和角膜上皮病变(多为1级)。
在疗效可评估的59例患者中,27例(27/59,45.8%)受试者疗效为部分缓解(PR),28例(28/59,47.5%)为疾病稳定(SD),4例为(4/59,6.8%)疾病进展(PD),总的客观缓解率(ORR)为45.8%,疾病控制率为(DCR)93.2%。其中1.5mg/kg Q3W剂量组的ORR达到了68.4%(13/19),既往使用过TKI药物受试者的ORR为44.7%(17/38)。较长1例患者(0.88 mg/kg Q3W)治疗时间达到了930天。
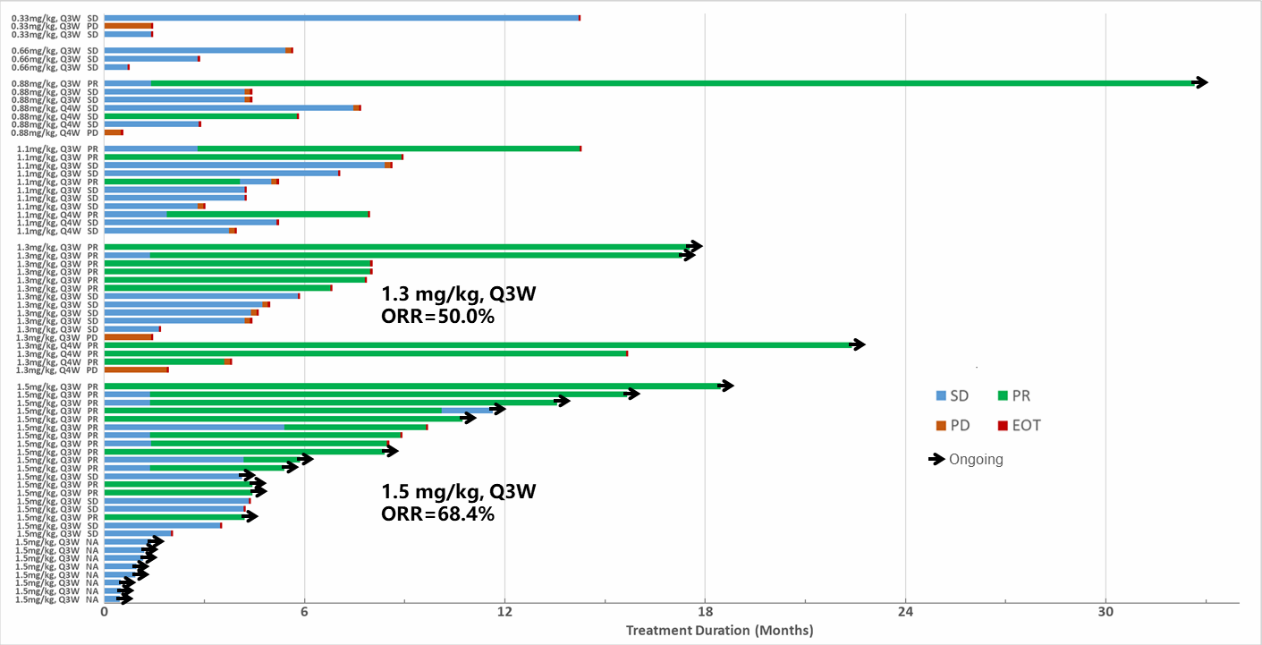
患者治疗时间
03研究结论
研究显示ARX788在既往多次治疗的HER2阳性晚期乳腺癌患者中有良好的耐受性,剂量爬升至1.5 mg/kg Q3W时,毒性在可接受范围内。药物缓解率随剂量水平的增加而增加,观察到令人鼓舞的总缓解率。考虑获益/风险比,已将1.5 mg/kg Q3W作为推荐剂量用于ARX788治疗HER2阳性乳腺癌的II/III期临床研究中。



